Ursachen und Abklärung
Definition:
Erhöhung der absoluten Lymphozytenzahl im peripheren Blut. Die Normwertgrenzen sind altersspezifisch. Bei Kindern liegen sie höher als bei Erwachsenen.
Der empfohlene Schwellenwert zur weiteren Abklärung einer Lymphozytose wird mit >5 G/L angegeben.
Ursachen:
- Infektionen
- Entzündliche Prozesse
- Malignome
| Infektionen | |
| Viral | |
| – Direkt Virus-assoziiert | Mononukleoseartiges Blutbild: EBV, CMV |
| – Post-viral | Mumps, Varizellen, infektiöse Hepatitis |
| Andere Erreger | |
| Bordetella pertussis | |
| Toxoplasmose | |
| akute Infektionen | |
| Syphilis | |
| Tuberkulose (abheilend) | |
| Brucellose | |
| Entzündliche Prozesse | |
| Zöliakie | |
| Autoimmunerkrankungen (z.B.Vaskulitis) | |
| Impfungen | |
| Medikamenten-Hypersensitivität | |
| Stress | |
| Endokrine Ursachen (Morbus Addison, Thyreotoxikose) | |
| Rauchen | |
| Malignome | |
| CLL | |
| Non-Hodgkin Lymphom |
Abklärung bei Lymphozytose.
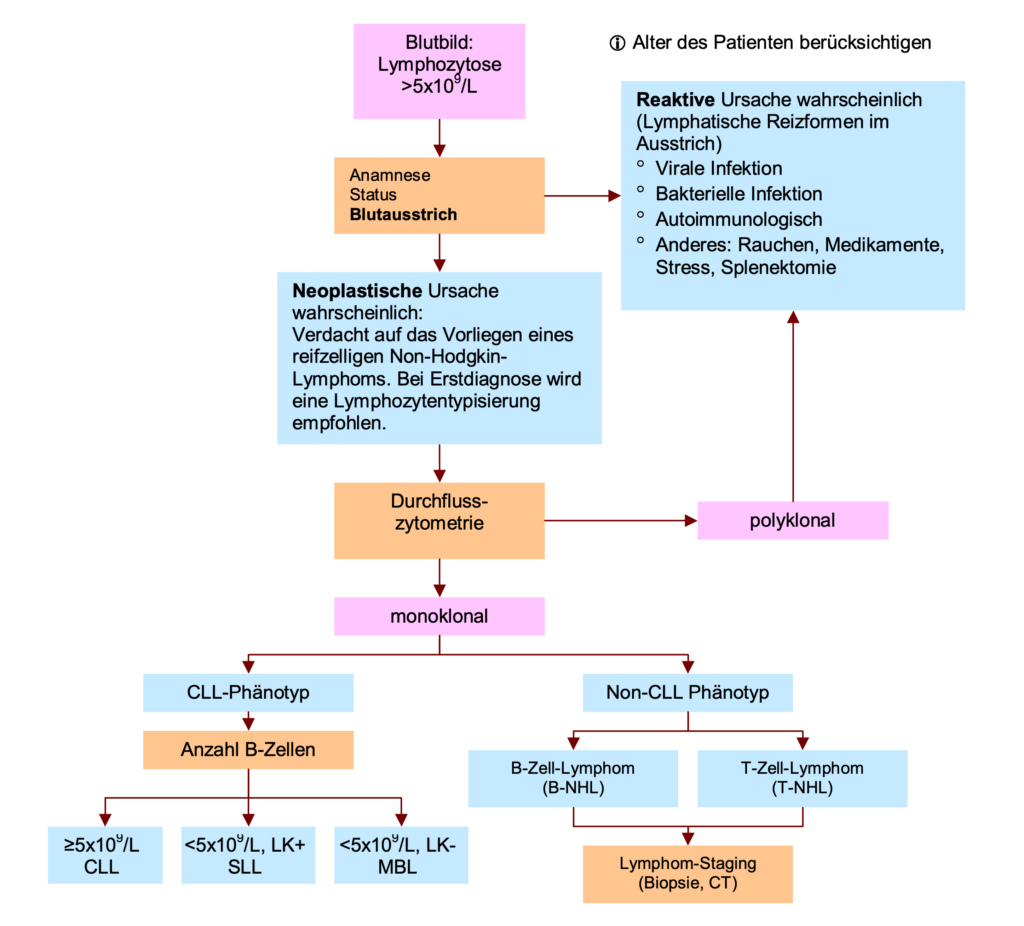
SLL: Small Lymphocytic Lymphoma. LK: Lymphknoten. MBL: Monoklonale B-Lymphozytose. NHL: Non-Hodgkin-Lymphom Quelle: mod. nach Lit. 4.
Diagnostische Vorgehensweise.
Blutausstrich.
In der mikroskopischen Beurteilung des Blutausstrichs kann ein erster richtungsweisender Eindruck gewonnen werden.
Bei der Herstellung des Ausstrichs können insbesondere Lymphomzellen (CLL), lymphatische Reizformen bei „infektiöser Mononukleose“ und leukämische Blasten kaputt gehen und als so genannte Kernschatten imponieren. Kernschatten sind nicht für eine bestimmte Erkrankung spezifisch.
Reaktive Lymphozytose.
Typischerweise ist bei reaktiven Ursachen einer Lymphozytose ein buntes, pleomorphes Bild zu sehen. Im Blutausstrich liegen Lymphozyten unterschiedlicher Größe und Form vor: Von klein und rund über mittelgroß mit weitem dunklen Zytoplasma bis hin zu Immunoblasten. Eine Ausnahme zu dieser Regel stellt die Lymphozytose bei Infektionen mit Bordetella pertussis dar: Die atypischen Lymphozyten sind hier monomorph, d.h. klein und stark gelappt mit reifem Chromatin.
Eine zweite Ausnahme ist die persistierende polyklonale B-Lymphozytose, bei der bilobuläre (zweikernige) Lymphozyten zu sehen sind (Anteil etwa 3%). Diese benigne Form der Lymphozytose ist über Jahre stabil. Betroffen sind vor allem Frauen <50 Jahre mit Nikotinabusus. Meistens besteht eine polyklonale IgM-Vermehrung. Eine Assoziation mit HLA-DR7 und dem gehäuften Auftreten eines Isochromosoms 3q wurde beschrieben.
Ursachen.
- Viral: EBV, CMV, VZV, Mumps, Influenza, Hepatitis, Röteln, Masern, HIV
- Bakteriell: Pertussis, Bartonellose, Rickettsiose, Toxoplasmose, Babesiose
- Autoimmunologisch: SLE u.a. Kollagenosen
- Medikamente und toxische Reaktionen
- Andere Auslöser: Rauchen, Stress, Splenektomie
Näheres zum Thema „Infektiöse Mononukleose“ finden Sie in der entsprechenden Fachinfo.
Neoplastische/maligne Lymphozytose.
Lymphome sind maligne Erkrankungen des lymphatischen Systems. Sie entstehen durch monoklonales Wachstum von genetisch veränderten lymphatischen Zellen.
Die Lymphomzellen stammen alle vom selben Klon ab und sind daher monomorph (haben alle das gleiche Aussehen).Die chronisch lymphatische Leukämie (CLL) gehört zu den Non-Hodgkin Lymphomen (NHL). Sie ist die häufigste Leukämieform in der westlichen Welt, allerdings können auch andere Lymphome (NHL) Lymphomzellen aus dem Knochenmark ins periphere Blut ausschwemmen (=leukämisch).Für die Identifizierung der Lymphozyten im peripheren Blut sind weitere Untersuchungsmethoden notwendig.
Durchflusszytometrie.
Methode.
Mittels Durchflusszytometrie werden Zellen anhand ihrer spezifischen Eigenschaften (Größe, Granularität) klassifiziert. Um zusätzliche Informationen zu erhalten werden die Zellen mit Antikörpern gegen definierte Oberflächenmerkmale (=CD-Klassifikation) markiert. Diese
Antikörper sind mit einem Fluoreszenzfarbstoff gekoppelt, der im Rahmen der Messung ein färbiges Lichtsignal abgibt.
Anhand der Auswertung von Größe, Granularität und Vorhandensein sowie Intensität der Lichtsignale (=Oberflächenmerkmale) werden die Zellen klassifiziert.
Bei Verdacht auf eine neoplastische Ursache einer Lymphozytose wird mittels Durchflusszytometrie eine sog. Lymphozytentypisierung durchgeführt.
Anhand des spezifischen Markerprofils welches die Lymphomzellen exprimieren kann
- eine Aussage über die Klonalität der Lymphozyten und
- die Zuordnung zu einer Lymphomentität getroffen werden.
Interpretation.
Die Lymphozytentypisierung ermittelt ob eine klonale (=von einem Klon abstammende) Vermehrung von B-Zellen oder T-Zellen vorliegt.
In den meisten Fällen wird bei leukämischer Ausschwemmung von Lymphomzellen eine CLL detektiert. Bei Vorliegen eines Nicht-CLL Phänotyps muss eine weitere Abklärung mittels Histopathologie von lymphatischem Gewebe (Lymphknoten, Knochenmark, etc.) erfolgen. Zum Staging und für die Prognose sind weitere Untersuchungen wie Computertomografie und molekulargenetische Tests notwendig.
Nähere Informationen zu Staging, Risikostratifizierung und Therapie entnehmen Sie den entsprechenden Leitlinien und der Literatur.
Chronisch Lymphatische Leukämie (CLL) und Monoklonale B-Lymphozytose (MBL).
Die Chronisch Lymphatische Leukämie (CLL) ist die häufigste Leukämie im Erwachsenenalter in Europa. Die Inzidenz liegt bei 2-6 Fälle pro 100.000 Einwohner, Zunahme mit steigendem Alter.
Zur Erfüllung der Diagnosekriterien für CLL muss eine klonale B-Zellpopulation >5×109/L mit einem CLL-Phänotyp im peripheren Blut nachweisbar sein. Der charakteristische CLL- Phänotyp besteht aus der Koexpression von CD5, CD19 und CD23 sowie der schwachen Expression von CD20, CD79b und Surface-Immunglobulin.
Eine klinische Variante davon ist das SLL (small lymphocytic lymphoma). Hier ist eine Population von B-Zellen mit CLL-Phänotyp in vergrößerten Lymphknoten nachweisbar aber die Anzahl der Lymphomzellen im peripheren Blut ist <5×109/L.
Eine weitere wichtige Variante ist die seit 2005 existierende Entität der MBL: Monoklonale B-Zell-Lymphozytose.
Bei der MBL liegt bei ansonsten gesunden Individuen eine kleine Population zirkulierender monoklonaler B-Zellen vor. Der Grenzwert zur Unterscheidung zwischen MBL und CLL liegt gemäß der WHO-Klassifikation bei 5×109/L.
Der Immunphänotyp der MBL entspricht dem einer CLL, einer atypischen CLL oder Non-CLL (=CD5neg). Die Prävalenz ist abhängig vom Alter und liegt bei 40-60-Jährigen bei ~5%, bei >60-Jährigen bei >20%.
Unterschieden werden „low-count“ MBL (<0,5×109/L) und „high-count“ MBL. Die Unterscheidung ist klinisch wichtig, da „low-count“ MBL nur in Ausnahmefällen eine Progression zu einer CLL zeigen und bei diesen Patienten daher keine regelmäßigen Laborkontrollen erforderlich sind. Im Gegensatz dazu bedarf es bei Patienten mit einer „high- count“ MBL aufgrund des Progressionsrisikos von 1-2% pro Jahr einer jährlichen Kontrolle (Blutbild, Lymphknotenstatus).
Praktisch jeder CLL geht eine „high-count“ MBL voraus.
Sowohl die MBL als auch die CLL zeigen eine sehr starke genetische Prädisposition für ihr Auftreten und ihre Progression.
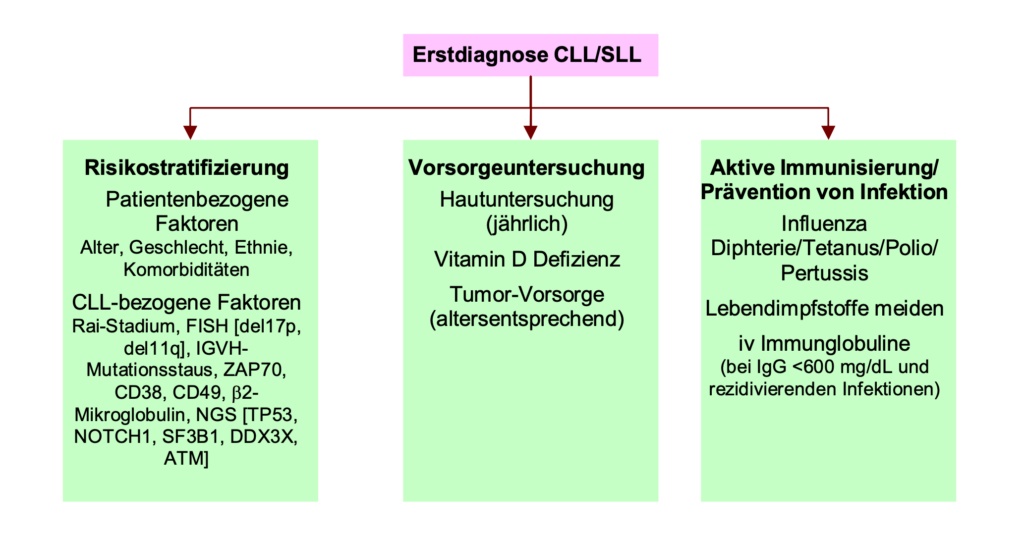
Risikofaktoren.
- Positive Familienanamnese
- Bestimmte genetische Polymorphismen
- Alter, Geschlecht
- Infektionen (HCV, Pneumonie, Influenza, Herpes Zoster)
- Unabhängige genetische Faktoren: CD38pos, del17p, IGVHunmutiert
Management von early-stage CLL und SLL.
Quellenangabe
- Brunkhorst R (Hrsg.), Schölmerich J. Differenzialdiagnostik und Differenzialtherapie. 1. Auflage 2010. Urban und Fischer
- Beck N. Diagnostic Hematology. Springer Verlag London Limited 2009
- George T I. Ask the Hematopathologist: Diagnostic Approach to Lymphocytosis. The Hematologist. Nov-Dec2015, Volume 12, Issue 6
- Strati P, Shanafelt T D. Monoclonal B-cell lymphocytosis and earlystage chronic lymphocytic leukaemia:diagnosis, natural history and risk stratification. Blood 2015 Volume 126 Number 4
- Löffler H, Rastetter J, Haferlach T. Atlas der klinischen Hämatologie. 6. Auflage 2004. Springer-Verlag
- Swerlow S H, Campo E, et al. 2016 WHO classification of lymphoid neoplasms. Blood 2016 prepublishedonline march 15, 2016; doi: 10.1182/blood-2016-01-643569
