MGUS – Smoldering Myelom – Multiples Myelom
Das Vorhandensein eines M-Gradienten in der Serum-Elektrophorese wird als monoklonale Gammopathie bezeichnet.
Die Ursache ist eine maligne Proliferation und Akkumulation von klonalen Plasmazellen (bzw. endständig differenzierten B-Zellen).
Sie produzieren und sezernieren ein monoklonales Immunglobulin (= IgG, IgA, IgM [selten: IgD, IgE] oder Leichtketten Kappa und Lambda), welches als Paraprotein bezeichnet wird. Bei etwa 80% der Patienten werden vollständige Immunglobuline gebildet, bei den restlichen 20% werden nur die Leichtketten hergestellt. Der Immunglobulin-Typ wird am diagnostischen Beginn festgestellt und ändert sich im Verlauf normalerweise nicht mehr.
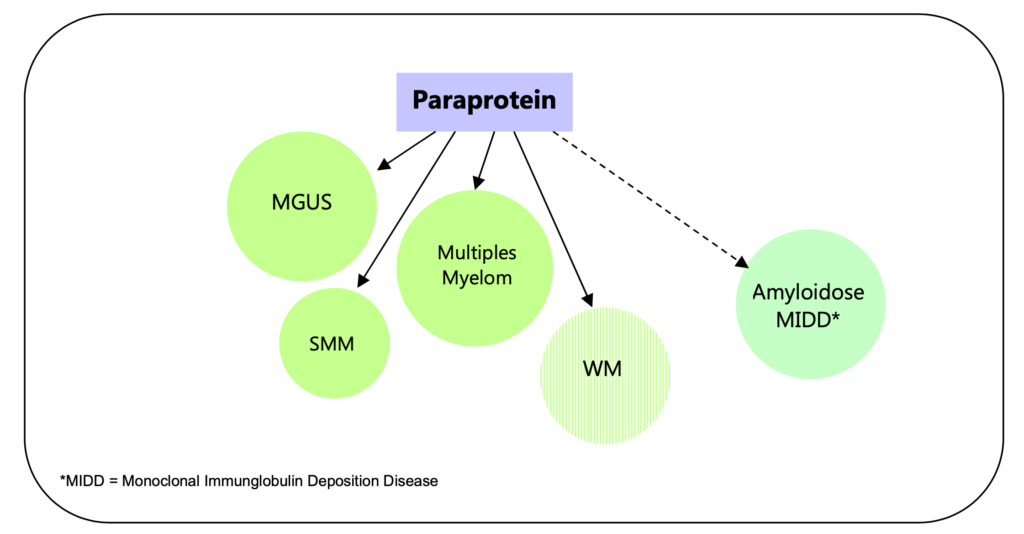
Die Diagnosekriterien (siehe Tabelle 1) der verschiedenen Entitäten betreffen u.a.
- den Isotyp der Schwerkette
- die Höhe des M-Gradienten
- die Dichte der Plasmazellinfiltration im Knochenmark
- den Anteil an freien Leichtketten (Serum/Harn)
- das Ausmaß an Endorganbeteiligung/-schäden.
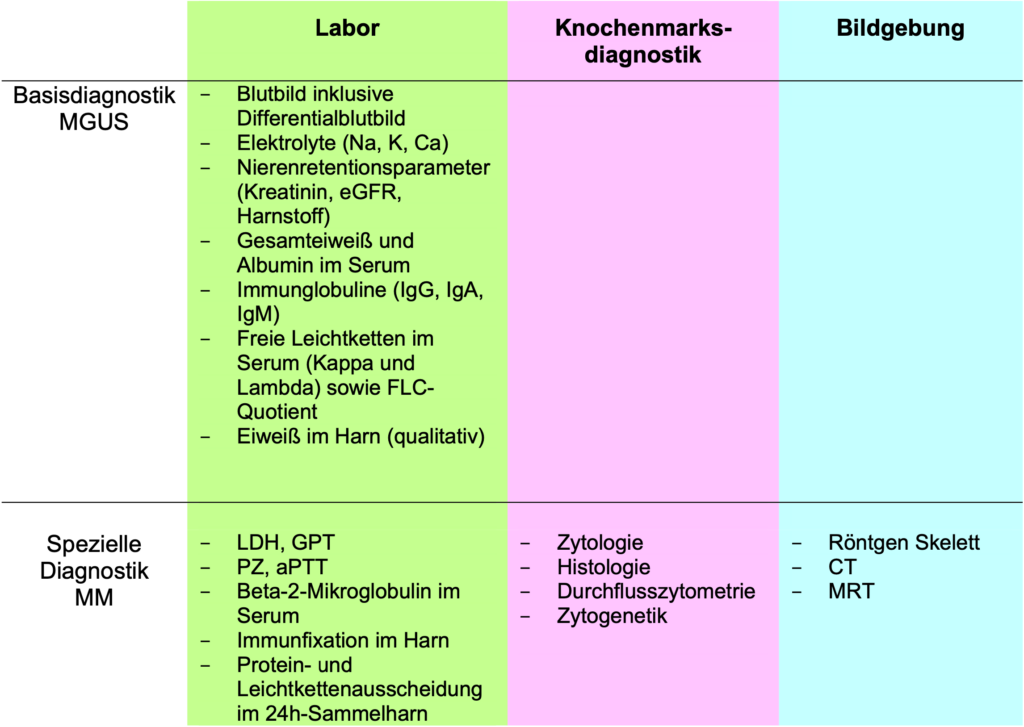
Diagnostik

MGUS (= Monoklonale Gammopathie unklarer Signifikanz)
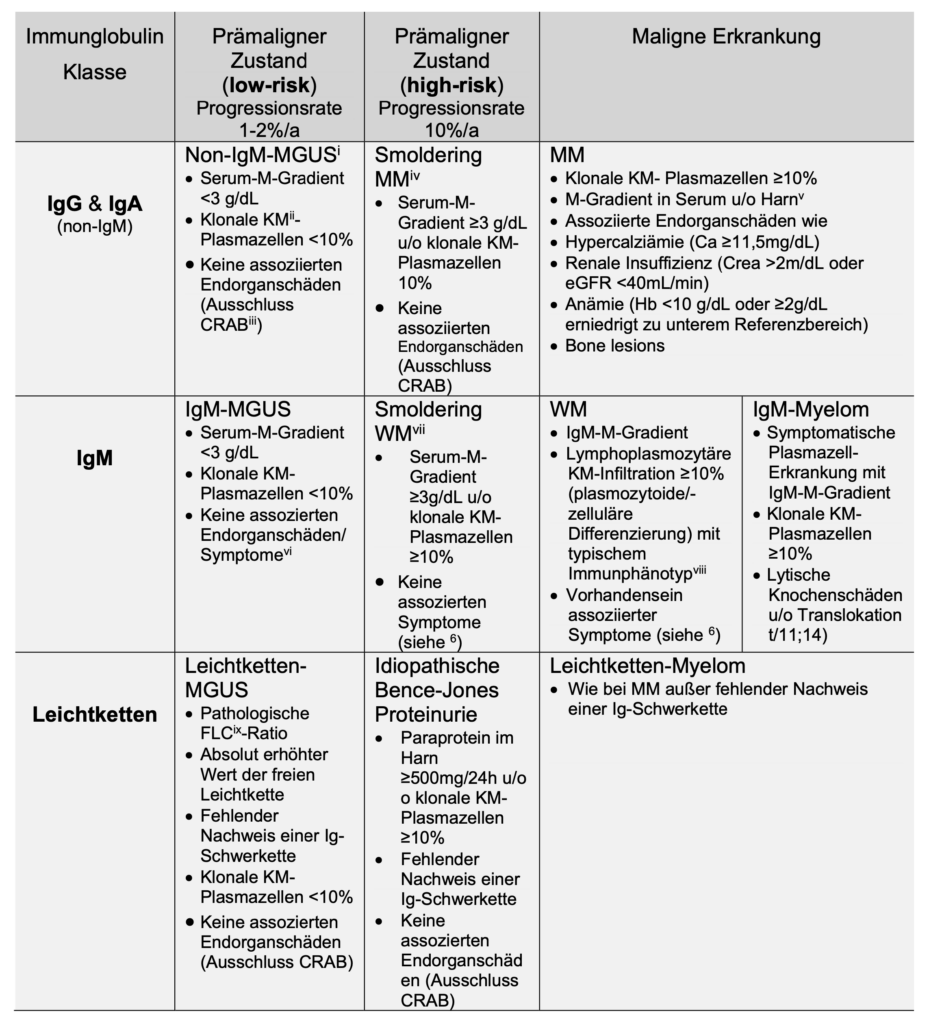
Non-IgM-MGUS (IgG, IgA)
Das MGUS gehört zu den Plasmazellerkrankungen mit geringer Malignität. Die Progressionsrate in ein Multiples Myelom liegt bei 1-2%/a.
MGUS sind bei asymptomatischen Patienten meistens Zufallsbefunde im Rahmen der Messung einer Serum-Elektrophorese in der ein M-Gradient entdeckt wird.
Prävalenz
Die Häufigkeit liegt bei 1-3% bei >50 Jahre; sie steigt jedoch mit zunehmendem Alter: 5% bei >70a
9% bei >85%
Zytogenetik
Die klonalen Immunglobuline (IgG, IgA) werden von postgerminalen Plasmazellen mit somatischer Hypermutation der variablen Region und Klassenwechsel, produziert.
In 50% der MGUS liegt eine Translokation der Schwerkette (IgH) in den anderen 50% ist eine Hyperdiploidie nachweisbar.
Kontrollen bei MGUS
Trotz des geringen Progressionsrisikos des MGUS von Jahr zu Jahr, besteht dieses lebenslang, weshalb Kontrollen notwendig sind. In Abhängigkeit von der Zuordnung zu low- risk oder high-risk MGUS unterscheiden sich die Kontrollintervalle und der Untersuchungsaufwand.
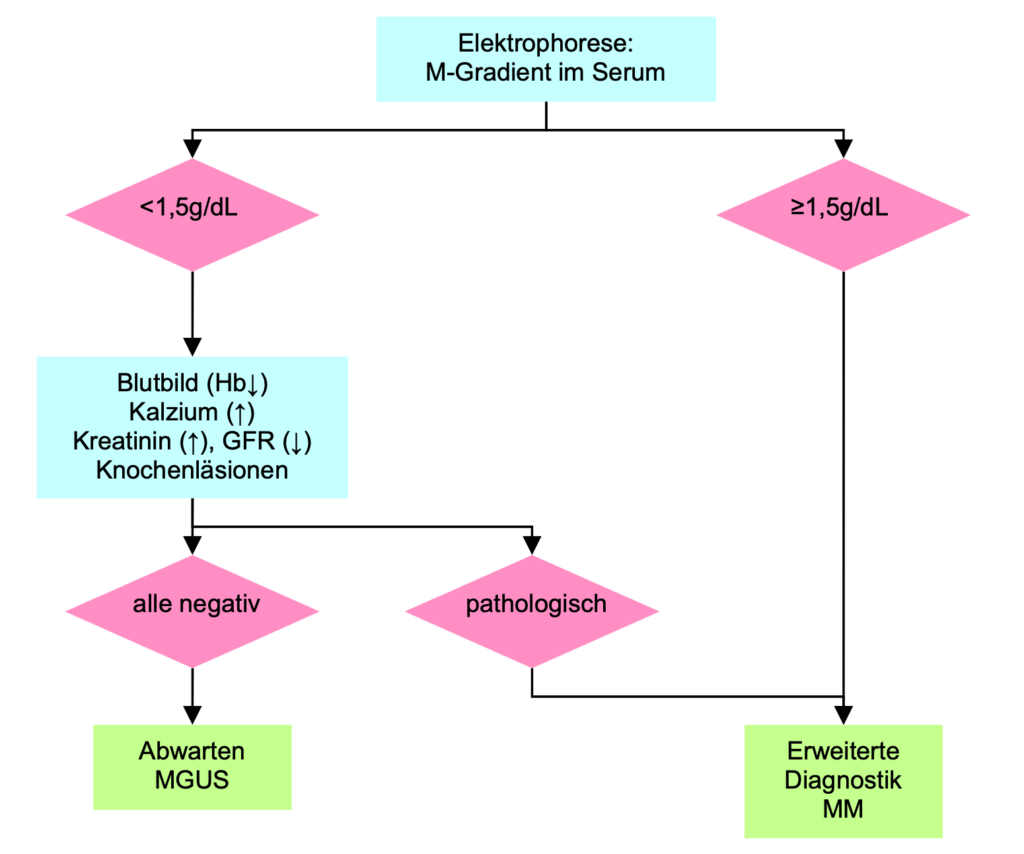
Das Risiko einer Knochenmarksinfiltration mit Plasmazellen >10% bei Patienten mit einem M-Gradienten 1,5 g/dL ist insgesamt sehr niedrig (7,3%), allerdings in Abhängigkeit vom Schwerketten-Isotyp: 4,7% für IgG, 20,5% für IgA.
Das Risiko für das Vorhandensein für Knochenläsionen ist vernachlässigbar klein (2,5%) unabhängig vom Schwerketten-Isotyp.
Asymptomatische Patienten mit einem M-Gradienten <1,5 g/dL der Klasse IgG brauchen keine Knochenmarksuntersuchung, während Patienten mit einem M-Gradienten der Klasse IgA in der diagnostischen Aufarbeitung immer eine KM-Untersuchung beinhalten soll. Skelettuntersuchungen sind nicht nötig.

Risiko-Stratifizierung und Einteilung des MGUS
Bekannte Risikofaktoren für Progression
- M-Gradient ≥1,5 g/dL
- Non-IgG-Schwerkette
- Abnormale FLC-Ratio (Normal: 0,26 – 1,65)
Das 20-Jahr-Progressionsrisiko für Patienten OHNE diese Risikofaktoren liegt bei 5%; bei Nachweis ALLER drei Risikofaktoren bei 20%.
IgM-MGUS und Waldenström Makroglobulinämie (WM)
MGUS mit einem Paraprotein IgM werden als eigene Entität behandelt, da sie sich hinsichtlich Symptomatik und Progressionsrate von den Non-IgM-MGUS unterscheiden. Im Gegensatz zu diesen stammt das IgM von B-Lymphozyten mit somatischer Hypermutation der IGV-Gene ohne Klassenwechsel ab.
Die Progressionsrate in eine maligne Erkrankung liegt bei ca. 1,5%/a, wobei IgM-MGUS eher in eine lymphoproliferative Erkrankung (Lymphoplasmozytisches Lymphom = Waldenström Makroglobulinämie oder andere Non-Hodgkin-Lymphome vor allem CLL) transformieren, als in ein IgM-MM. Klinisch und biologisch besteht eine starke Assoziationen zwischen WM und CLL. IgM-Paraproteine werden häufig auch bei CLL oder anderen NHL gefunden.
Klinisch stehen oft die Verdrängung der regelrechten Hämatopoese im Knochenmark, Durchblutungsstörungen aufgrund der Hyperviskosität durch das Paraprotein sowie Autoimmunphänomene (Autoimmunhämolytische Anämien, Immunthrombopenien, Gerinnungsstörungen) im Vordergrund.
Multiples Myelom
Ein multiples Myelom wird entweder de novo entdeckt oder entwickelt sich aus einem vorher bestehenden MGUS.
Prävalenz
In der EU liegt die Häufigkeit bei ca. 6 pro 100.000 Einwohner. Das MM ist eine seltene Erkrankung macht ca. 1% aller neoplastischen Erkrankungen und ca. 13% aller hämatologischen Neoplasien aus.
Das mittlere Manifestationsalter liegt zwischen 60 und 70 Jahren.
Klinik
Die Symptome sind zu Erkrankungsbeginn uncharakteristisch, daher wird die Diagnose häufig erst zu einem späteren Stadium erkannt wenn allgemeine Tumorsymptome auftreten. Die spezifischen Symptome sind auf direkte und indirekte Wirkungen der malignen Plasmazellen zurückzuführen:
- Zytopenien
- Osteolysen
- Sekundäre Immundefizienz
- Renale Insuffizienz
Der proliferierende maligne Plasmazellklon führt zur Verdrängung der gesunden Hämatopoese im Knochenmark und damit zur Insuffizienz der Blutbildung mit Anämie und Thrombopenie. Weiters beeinflussen die Myelomzellen direkt sowie durch Interaktion mit Zellen des Knochenmark-Milieus den physiologischen Knochenstoffwechsel und die zelluläre und humorale Immunität. Die Folge sind die krankheitstypischen Osteolysen (mit Knochenschmerzen und Hyperkalziämie) sowie rezidivierende Infektionen.
Die monoklonale Leichtkettenproteinurie führt zur Schädigung der Nierentubuli und damit zu renaler Insuffizienz – „Myelomniere“.
Amyloidose
Die Amyloidose gehört zur Erkrankungsgruppe der Monoclonal immunglobulin deposition diseases (MIDD).
Hierbei lagern sich im Überschuss gebildete monoklonalen Immunglobuline bzw. Immunglobulinfragmente (Leichtketten, Schwerketten) extrazellulär im Gewebe ab. Die zugrunde liegende Ursache sind Plasmazellerkrankungen oder lymphoplasmozytische Lymphome. Die Folge sind Organschäden, insbesondere betroffen sind Nieren, Leber, Milz, Magen-Darm-Trakt, Nervensystem, Herz.Bei etwa 20% der Patienten ist ein Multiples Myelom vorhanden, während in den meisten Fällen die Kriterien für ein MGUS erfüllt sind. Etwa 10% der Myelom-Patienten entwickeln im Verlauf eine Amyloidose.
Quellenangabe
- Wörmann, B u.a.: Leitlinie Multiples Myelom. http://www.dgho- onkopedia.de/de/onkopedia/leitlinien/multiples-myelom
- Buske, C u.a.: Leitlinie Morbus Waldenström. http://www.dgho-onkopedia.de/de/onkopedia/leitlinien/morbus-waldenstroem
- Kortüm, M u.a.: Leitlinie Morbus Waldenström. http://www.dgho-onkopedia.de/de/onkopedia/leitlinien/monoklonale-gammopathie-unklarer-signifikanz-mgus
- McMaster, ML; Landgren, O. Prevalence, clinical aspects, and natural history of IgM MGUS. Cytometry Part B 2010, 78B (Suppl. 1): S91-S97
- Mangiacavalli, S; Cocito, F; Pochintesta, L et al. Monoclonal gammopathy of undeterminded significance: a new proposal of workup. European Journal of Haematology 91 (356-360)
- Rossi, F; Petrucci, MT; Guffanti, A et al. Proposal and Validation of Prognostic Scoring Systems for IgG and IgA Monoclonal Gammopathies of Undetermindes Significance; Clinical Cancer Research 2009; 15:4439- 4445
- Rajkumar, SV; Kyle, RA; Buadi, FK. Advances in the Diagnosis, Classification, Risk Stratification, and Management of Monoclonal Gammopathy of Undetermined Signficance: Implications for Recategorizing Disease Entities in the Presence of Evolving Scientific Evidence. Mayo Clinic Proceedings October 2010; 85(10):945-948
- Galson, DL; Silbermann, R; Goodman, GD. Mechanism of multiple myeloma bone disease. BoneKEy Reports 1: Article Number: 135(2012)
Abkürzungen
MGUS = Monoklonale Gammopathie unklarer Signifikanz
KM = Knochenmark
CRAB = Hypercalziämie, renale Insuffizienz, Anämie, Bone lesions
MM = Multiples Myelom
Außer bei nonsekretorischem Myelom
Anämie, Hyperviskosität, Lymphadenopathie, Hepatosplenomegalie vii Waldenström Makroglobulinämie
IgM+, CD5+/-, CD10-, CD19+, CD20+, CD23-
FLC = Free Light Chain
